2018信州総文祭
酸化されにくい銅の酸化のしくみを起電力から検証
【化学】富山県立富山中部高校 スーパーサイエンス部

■部員数 17人(うち1年生1人・2年生7人・3年生9人)
■答えてくれた人 西田結哉くん(3年)
銅の腐食と起電力~NaCl水溶液と銅板を用いた電池の起電力の要因~
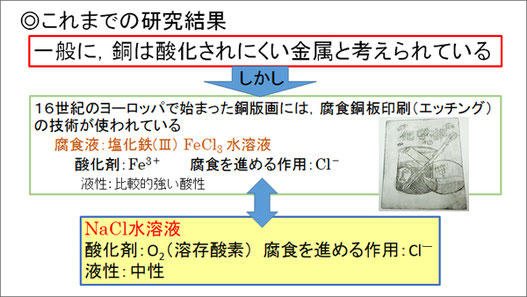
高濃度のNaCl水溶液中では銅も腐食する
一般に、銅は酸化されにくい金属だと考えられています。しかし、16世紀のヨーロッパで始まった銅版画には、エッチングという銅を腐食させる技術が用いられています。エッチングでは、腐食液として、比較的強い酸性の塩化鉄(Ⅲ)FeCl3水溶液が使われ、この水溶液中の鉄(Ⅲ)イオンFe3+が酸化剤としてはたらき、塩化物イオンCl-が腐食を進める作用を示しています。私たちは、中性のNaCl水溶液中でも、空気中から溶け込んだ溶存酸素が酸化剤としてはたらき、Cl-が同様に酸化をすすめることで、NaCl水溶液中で銅板が腐食されるのではないかと考え、実験を行いました。
その結果、1.0×10-5 mol/Lよりも低い濃度のNaCl水溶液中では銅はほとんど変化しませんが、それよりも大きい濃度のNaCl水溶液中では銅が腐食されていることが確認できます。また、濃度が高いほど酸化が進みやすいこともわかります。

次に、溶存酸素量と銅の腐食の関係について調べました。溶液上部に何もせず空気にさらした状態、すなわち溶存酸素が多い状態では、銅の腐食が盛んに進みました。一方、食用油で上部を覆い、溶存酸素が少ない状態にしたサンプルでは、銅板に大きな変化は見られず、腐食が進みにくかったことがわかります。

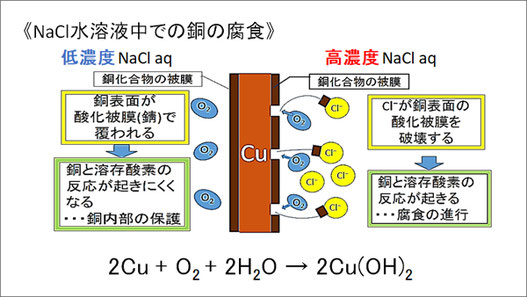
この結果を踏まえ、私たちは次のような仮説を立てました。低濃度のNaCl水溶液中では、銅板表面が酸化被膜で覆われて、銅内部が保護されて銅と溶存酸素の反応が起きにくくなるため、それ以上酸化が進みません。しかし、高濃度のNaCl水溶液中ではCl-が錯体を作って酸化被膜を破壊するはたらきを持つため、銅と溶存酸素の反応が妨げられることがなくなり、腐食が進行すると考えました。
NaCl水溶液の濃度を変えれば、両極が銅板の電池ができる?
そして、このNaCl水溶液の濃度による酸化反応の進行の違いに着目し、電池を作製することができるのではないかと考えました。
実際に実験を行ってみると、高濃度のNaCl水溶液中では銅が腐食されやすいため、銅がイオンとして溶け出す酸化反応が起こり負極となり、低濃度のNaCl水溶液中では、銅板表面で溶存酸素が電子を受け取る還元反応が起こり正極となるような電池を作製することに成功しました。

さらに、正極側のNaCl水溶液を、ポリアクリル酸ナトリウムを用いてゾル状にし、上部に活性炭を載せて溶存酸素濃度を高める実験を行ったところ、起電力が0.05 Vから0.18 Vに上昇するという結果を得られたため、酸素が正極活物質であることを確認できました。
また負極側溶液の濃度を5.5 mol/Lにした際の起電力は0.29 V、内部抵抗は約50 Ωであったため、この電池が比較的大きな内部抵抗を持っていることもわかります。

塩化物イオンの役割は何か?
今回の研究では、上記のNaCl水溶液を用いた電池において、塩化物イオンが果たす役割について検証を行いました。そのために、三つの方法を試しました。
まず、負極(高濃度NaCl水溶液側)に塩酸を加えて負極側のCl-濃度とH+濃度を上昇させ、起電力の変化を調べました。具体的には、正極側に0.09 mol/LのNaCl水溶液を、負極側に5.5 mol/LのNaCl水溶液を用いた電池を作成し、負極側に6 mol/Lの塩酸を0.6 mLずつ加えて起電力を測定しました。
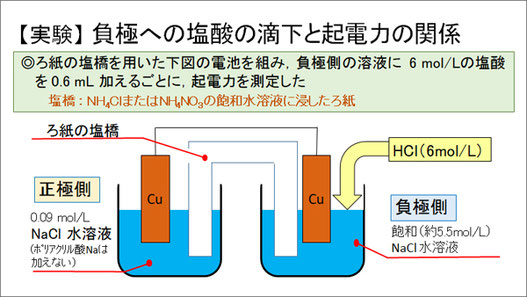
その結果、NH4Cl飽和水溶液に浸したろ紙を塩橋に用いた場合、塩酸を3.0 mL加えた時は、塩酸を加えなかった場合に比べ起電力が0.1 V上昇しました。一方、NH4NO3の飽和水溶液に浸したろ紙を塩橋に用いた場合、電圧は低下せず、一定に維持されました。この後時間が経過しても起電力に大幅な低下は見られなかったことから、起電力は上昇もしくは安定したと考えられます。この原因として、以下の四つのことが考えられます。
(1)Cl-濃度の上昇が、酸化被膜をさらに破壊しやすくしたこと
(2)増加したH+銅表面に生じた水酸化物、酸化物、炭酸化合物を溶解したこと
(3)塩酸が不溶性の塩化銅(Ⅰ)CuClを溶解したこと
(4)H+濃度の大幅な上昇により電気伝導度が向上したこと
です。

次に、負極側のNaCl濃度を変化させて起電力の変化を調べました。正極側の溶液には、0.09 mol/LのNaCl水溶液と、ポリアクリル酸ナトリウムを加えた同濃度のNaClゾルに活性炭を載せたものの二つを用意しました。
また、負極側溶液には、0.2 mol/Lから5.5 mol/Lまで7~9種類の濃度のNaCl水溶液を用いました。塩橋には0.1 mol/LのNH4Cl水溶液をゲル化したものを入れたU字管を使用しています。
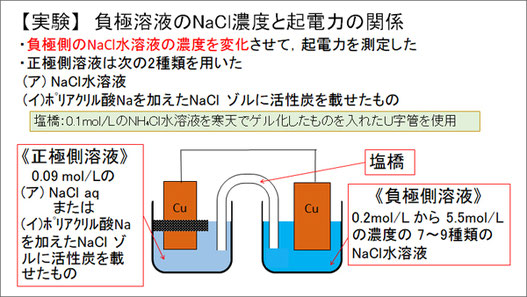
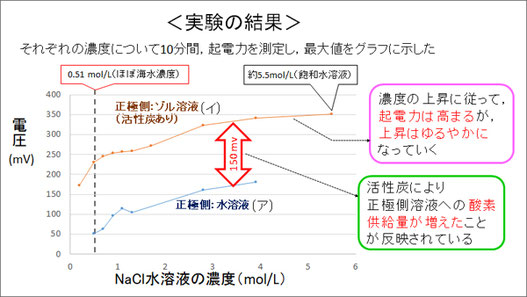
この実験の結果、正極側に活性炭ありのゾル溶液を用いた場合は、普通の水溶液を用いた場合に比べて、負極側の水溶液濃度にかかわらず約150 mVの起電力の上昇が確認できました。
これは正極活物質である溶存酸素の供給量が増えたことに起因すると考えられます。
また、負極側の水溶液の濃度が上昇するのに従い、起電力も高まっていきますが、その上昇の度合いは徐々にゆるやかになっていくこともわかりました。
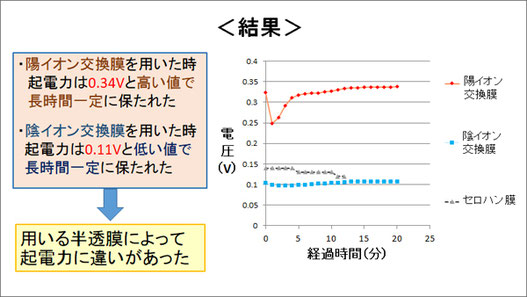
最後に、負極と正極のNaCl水溶液を陽イオン交換膜で直接仕切り、拡散による両極のCl-濃度の変化を起こさないようにすることで起電力が変化するかを確かめる実験を行いました。

陽イオン交換膜のほか、陰イオン交換膜、セロハン膜の三種類の半透膜を用いて両極を仕切り、起電力を比較した結果、陽イオン交換膜を用いた場合の起電力は0.34 Vと比較的高い値で一定に保たれた一方、陰イオン交換膜を用いた場合は、0.11 Vという低い値で長時間一定に保たれたことから、用いる半透膜によって起電力が大きく異なることがわかりました。
この原因について私たちは次のように考察しました。
陽イオン交換膜を用いた場合は、陰イオンを通さないため、銅表面の酸化促を起こしやすくするCl-の濃度が常に一定になります。これによって起電力が高く保たれるのだと考えました。また、陽イオンが陽イオン交換膜を通じて拡散することや、正極側で銅イオンが水酸化物イオンと反応することなども一因だと考えられます。

起電力の違いは銅の「質」なのか、酸化された銅の「量」なのか
ここまでの実験では、NaCl水溶液の濃度の違いによる銅板の酸化の様子の違いを、起電力と対応させて考えてきました。私たちはさらに、起電力に影響を与えている銅の酸化の違いが、銅板表面の様子や生成物の組成といった「質」によるものなのか、それとも酸化された銅の「量」によるものなのか、詳しく調べるために次のような実験を行いました。

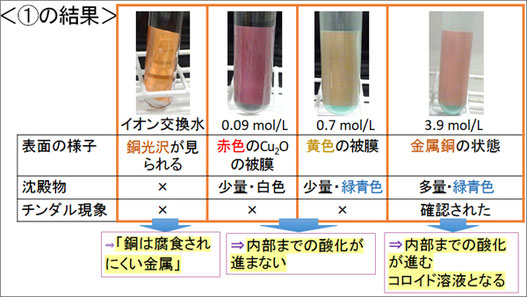
まず、銅の酸化の「質」について調べるために、0.09 mol/Lから5.5 mol/Lの11種類の異なる濃度のNaCl水溶液を入れた試験管、何も入れない(空気のみを入れた)試験管、イオン交換水を入れた試験管の13本のサンプルを用意しました。これらに銅板を入れ、試験管上部を脱脂綿で覆い、水の蒸発を抑制してNaCl水溶液の濃度を一定に保った状態で60日間の変化の様子を観察しました。

その結果、比較的低濃度の水溶液中では表面に酸化被膜が生じるため内部まで酸化が進んでいません。一方、比較的高濃度の水溶液中では、多量の沈殿が観察できることから内部まで酸化が進んでいると予測できます。またチンダル現象が確認できたことから、銅化合物がコロイドを形成していることも考えられます。
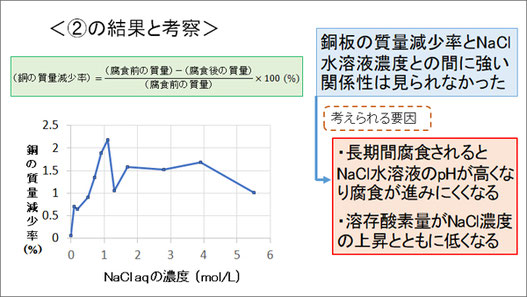
次に、銅板の酸化の「量」について調べるために、腐食によって銅板質量がどの程度減少したかを測定しました。試験管から取り出した銅板をイオン交換水で洗浄した後、濃塩酸で洗浄して、銅板表面の酸化被膜や塩化銅を取り除き、乾燥させ、すぐに質量を測定しました。その結果、銅板の質量減少率とNaCl水溶液の濃度との間に強い関係性は見られませんでした。この要因としては、長期間の腐食によりNaCl水溶液のpHが高くなり、腐食が進みにくくなることや、NaCl水溶液の濃度上昇にともない溶存酸素量が減少することが考えられます。
以上の二つの実験結果から、酸化される銅の質量は、NaCl水溶液の濃度とあまり関係しない一方で、溶液中の銅化合物のコロイド形成や沈殿の組成、銅板表面の様子などにみられる「銅の酸化のされ方」、すなわち「質」の違いが、電池の起電力に大きな影響を与えたのではないかと考察しました。

「銅の酸化されやすさ」は塩化物イオンの濃度で決まる
今回の研究の結果から、次のような結論が導き出されました。
銅は、一般に酸化されにくい金属とされていますが、塩化物イオンCl-が多量に存在する水溶液中では酸化されやすくなります。また、Cl-濃度の異なる水溶液中では酸化のされやすさが異なるため、正極と負極で濃度の異なるNaCl水溶液を用いることで電池を作製できます。この電池の起電力に関して、正極側では、正極活物質である溶存酸素が多いほど起電力が上昇し、負極側では塩化物イオンが濃度に応じて「銅の酸化のされ方」が変化して、濃度が大きいほど起電力が上昇しています。

今後は、異なる濃度のNaCl水溶液中における銅の腐食の様子の違いを、酸化反応の機構や反応に必要なエネルギーの違いなどのよると推測し、実際に調べていきたいと考えています。
■研究を始めた理由・経緯は?
先輩から引き継いだ研究です。先輩方は、銅を含む合金などについて研究を行ってきていて、その過程でCl-の濃度と金属の腐食の関係についてわかってきました。このことをさらに突き詰めて研究したものが本研究です。
■今回の研究にかかった時間はどのくらい?
2年前から、週5日程です。
■今回の研究で苦労したことは?
ポリアクリル酸Naを含む水溶液を調製すること、結果を測定すること。結局のところ、全てたいへんだったのかもしれません。
■「ココは工夫した!」「ココを見てほしい」という点は?
活性炭をのせて酸素を溶液に供給した点。
■今回の研究にあたって、参考にした本や先行研究
1) 「海水・塩水・さび ―塩分があると金属はどうしてさびやすいか―」井上博之
ソルト・サイエンス・シンポジウム 2012 講演1
2) 「基礎からわかる 金属腐食」藤井哲雄(日刊工業新聞社出版)2011年
3) 「よくわかる最新さびの基本と仕組み」長野博夫、松村昌信(秀和システム出版)2010年
4) 「腐食防食の実務知識」 松島巌(オーム社)2014年
5) 「金属の溶解機構の解析とその工業的応用に関する研究」
久保田賢治(宇都宮大学大学院工学研究科博士学位論文(2013/3月)
6) 「塩化物イオン存在下での金属の腐食」富山県立富山中部高等学校 SS部
(第40回全国高等学校総合文化祭 2016ひろしま総文 自然科学部門論文集)
7) 「塩化ナトリウム型ボルタ電池の正極反応」北海道旭川東高等学校 化学部
(第38回全国高等学校総合文化祭 いばらき総文2014自然科学部門論文集)
8)「電気化学 教師のための化学実験 ケミカルデモンストレーション7」Bassam.Z.Shakuhashiri著
池本勲:訳(丸善株式会社) 1999年
9) 「楽しい化学の実験室Ⅱ 電池のいろいろ-濃淡電池の仕組み-」太田健一郎・神谷信行(東京化学同人)1995年
10) 「銅の腐食と起電力」富山中部高校スーパーサイエンス部
(第14回化学グランドコンテスト発表論文)
11) 「アルカリ乾電池のエネルギー密度に関する実験と考察」
秋田県立大曲工業高等学校 窪田美羽
12)『驚きの錆落とし~あっという間に10円がピカピカに!~』
■今回の研究は今後も続けていきますか?
この研究は、今回の総文祭で一区切りをする予定です。次は、NaClの結晶の研究などを考えています。
■ふだんの活動では何をしていますか?
ほとんどの日は研究をしていましたが、時折、世界史など、多分野にわたる勉強会を開いていました。
■総文祭に参加して
部員と共に全国の高校生と交流することができて、自然科学への興味関心が高まったように思います。信州総文を通してお世話になった全ての方々に感謝申し上げます。
 みらいぶっくグループ
みらいぶっくグループ


















